ACS Nano:南京师范大学黄和/李亚楠团队开发生物酶纳米制剂,提高乳腺癌“饥饿疗法”效果
乳腺癌是女性最常见的癌症,也是目前世界第一大癌症。据世界卫生组织国际癌症研究署发布的2020年全球癌症负担数据,2020年全球新增乳腺癌226万例,占女性癌症新增病例的四分之一。
肿瘤组织对营养物质有着旺盛的需求,因此“饥饿疗法”是一种具有前景的靶向治疗手段。然而,代谢可塑性使乳腺癌细胞能够在不利的饥饿条件下存活。哺乳动物雷帕霉素靶蛋白(mTOR)和缺氧诱导因子-1(HIF-1)这两种关键调控因子与谷氨酰胺和葡萄糖这两大重要营养基质的动态代谢密切相关,维持了乳腺癌的营养通量。此外,阻断营养物质来源乳腺癌会启动自噬功能,从自噬溶酶体中的生产营养基质,加剧了肿瘤的转移和进展。
2024年1月26日,南京师范大学食品与制药工程学院黄和/李亚楠团队(青年教师孟伶通、杨靖鹏为论文第一作者)在国际著名必威手机官网ACS Nano上发表了题为:Biomimetic Nanomedicine Targeting Orchestrated Metabolism Coupled with Regulatory Factors to Disrupt the Metabolic Plasticity of Breast Cancer的研究论文。
该研究提出了一种新型靶向治疗策略,通过仿生纳米药物靶向耦联调节因子的互补式代谢网络,克服乳腺癌的代谢可塑性,提高饥饿疗法的治疗效果。

与其他常见癌症相比,乳腺癌更依赖于mTOR和HIF-1来协调代谢网络。因此,研究团队开发了一种级联放大式一体化纳米制剂,用以重构乳腺癌组织中偶联调节因子的互补式代谢网络。葡萄糖氧化酶有效地消耗葡萄糖,而包裹在葡萄糖氧化酶内部的雷帕霉素有效限制了谷氨酰胺的代谢通量,同时解偶联了mTOR和HIF-1的负反馈调节作用。通过芬顿反应级联产生的羟基自由基可以有效在后期阶段阻断自噬流,从而限制乳腺癌细胞从自噬流中获取营养基质。
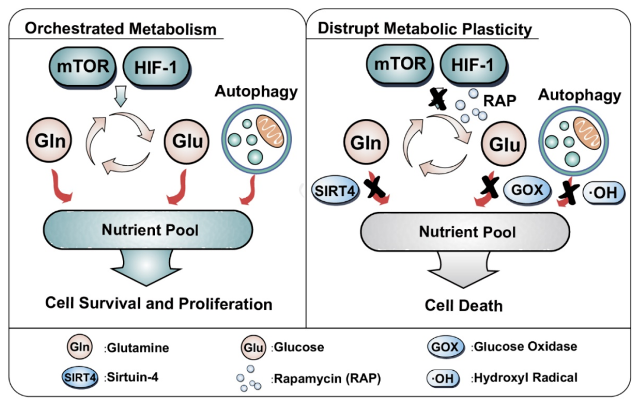
靶向偶联调节因子的互补式营养代谢的治疗机理
这一靶向互补式营养代谢的纳米制剂可以破坏乳腺癌组织中葡萄糖、氨基酸、核苷酸、脂质等代谢途径的协调作用,有效提高抗肿瘤效果和治疗预后。总的来说,该研究提供了一个具有前景的治疗策略来解决肿瘤代谢可塑性问题和生物酶高效递送的问题。
南京师范大学青年教师孟伶通和青年教师杨靖鹏为论文共同第一作者,李亚楠副教授和黄和教授为论文通讯作者。
(来源:生物世界)
原文出处:Meng L, Yang J, Gao Y, Cao Q, Jiang S, Xiao Y, Wang H, Liu W, Yuan A, Li Y, Huang H. Biomimetic Nanomedicine Targeting Orchestrated Metabolism Coupled with Regulatory Factors to Disrupt the Metabolic Plasticity of Breast Cancer. ACS Nano. 2024 Jan 26. doi: 10.1021/acsnano.3c10129. Epub ahead of print. PMID: 38277483.